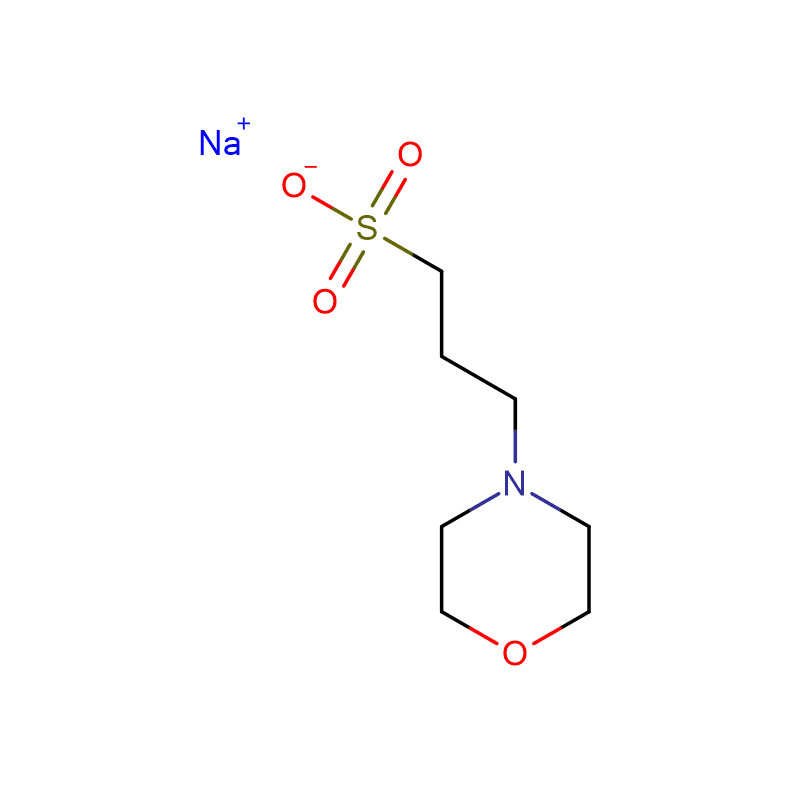
HEPBS Cas:161308-36-7 N- (2- Hydroxyethyl) piperazine- N'- (4- butanesulfonic acid) Бел кристален прав 99%
| Број на каталог | XD90100 |
| Име на производ | HEPBS |
| CAS | 161308-36-7 |
| Молекуларна формула | C10H22N2O4S |
| Молекуларна тежина | 266,36 |
| Детали за складирање | Амбиентален |
| Усогласен тарифен код | 2933599090 |
Спецификација на производот
| Изглед | Бел кристален прав |
| Асаy | ≥ 99% |
| Температура на складирање | Продавница во RT |
| Точка на топење | 211-216°C |
| Коефициент на киселост (pKa) | 8,3 (на 25℃) |
Ја разбираме важноста на заштитата на интегритетот на вашите биомолекули и реагенси со вистинските баферски системи.Нашите биолошки пуфери обезбедуваат стабилност на растворот и контрола на pH без да се мешаат во биолошките процеси и обезбедуваат критични соли и хранливи материи за клетките и ткивата.Нашите напредни пуферски системи може да ви донесат феноменална стабилност при клеточна култура, полимеразна верижна реакција (PCR), скрининг на лекови, биопроцесирање, прочистување и апликации за финална формулација.Сите наши производи може да се намалат од рано истражување до комерцијални апликации во различни степени на тампон.Нудиме бројни конфигурации за пакување, прилагодено мешање, па дури и течна формулација.
Ние, исто така, обезбедуваме сеопфатен избор на висококвалитетни биохемикалии во практичен опсег на оценки и во различни иновативни опции за пакување кои се прифатливи за корисниците.Покрај производите што се достапни на полица, ние нудиме прилагодено производство, мешање и пакување на реагенси за да ги задоволиме вашите потреби.
Принципот на работа и pH вредноста на пуферскиот раствор Кога во некои раствори се додава одредена количина киселина и алкали, тоа има ефект да ја попречи промената на pH на растворот, што се нарекува пуферски ефект.Таквото решение се нарекува пуферско решение.Мешани раствори на слаби киселини и нивни соли (како HAc и NaAc) и мешани раствори на слаби бази и нивни соли (како NH3·H2O и NH4Cl) се пуферски раствори.Пуферирачкиот ефект на пуферскиот раствор составен од слабата киселина HA и нејзината сол NaA врз киселината се должи на присуството на доволно количество на алкали A- во растворот.Кога во овој раствор се додава одредена количина силна киселина, јоните на H во основа се трошат од А-јоните: така што рН на растворот е речиси непроменет;кога се додава одредена количина силна база, слабата киселина HA присутна во растворот троши OH- јони ја попречуваат промената на pH.



![TAPS-NA Cas:91000-53-2 Течна 99% N-[Трис(хидроксиметил)метил]-3-аминопропансулфонска киселина натриумова сол](http://cdn.globalso.com/xdbiochems/91000-53-2.jpg)